GSK condivide dati positivi sul suo vaccino per adulti più anziani contro il virus respiratorio sinciziale (RSV), che indicano una protezione per due stagioni
- Nuovi risultati dello studio di fase III AReSVi-006 in corso mostrano l'efficacia del vaccino contro la malattia del tratto respiratorio inferiore da RSV e la malattia grave in due stagioni complete di RSV, anche nei partecipanti con condizioni mediche di base
- I dati sulla sicurezza e sulla reattogenicità erano coerenti con i risultati iniziali del programma di fase III
- Il programma di sviluppo clinico continuerà a valutare il follow-up a lungo termine e la tempistica ottimale per la rivaccinazione
GSK plc (LSE/NYSE: GSK) ha annunciato oggi nuovi dati dallo studio di fase III AReSVi-006 (Adult Respiratory Syncytial Virus) che valuta l'efficacia di una singola dose del proprio vaccino contro il virus respiratorio sinciziale, adiuvato contro la malattia del tratto respiratorio inferiore ( LRTD) causata dal virus respiratorio sinciziale (RSV) negli adulti di età pari o superiore a 60 anni in più stagioni di RSV e dopo rivaccinazione annuale.
Efficacia di una singola dose per due stagioni
I risultati mostrano che una dose del vaccino è efficace contro RSV-LRTD e grave LRTD per due stagioni complete di RSV.
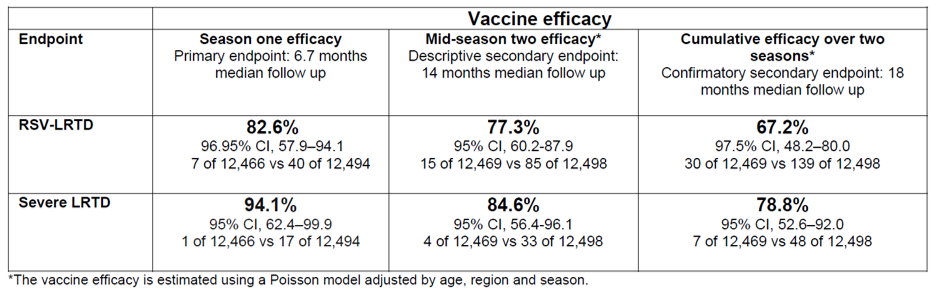
Un modello simile di efficacia del vaccino nell'arco di due stagioni è stato osservato anche negli adulti con comorbidità sottostanti e con l'avanzare dell'età, rafforzando l'impatto che il vaccino potrebbe avere sui soggetti più a rischio di esiti gravi di RSV.
Rivaccinazione
Lo studio ha anche valutato l'efficacia dopo un programma di rivaccinazione annuale come endpoint secondario di conferma. L'efficacia cumulativa nell'arco di due stagioni nei partecipanti che hanno ricevuto una seconda dose del vaccino è stata del 67,1% (IC 97,5%, 48,1-80,0, 30 su 12.469 vs 139 su 12.498), suggerendo che la rivaccinazione dopo 12 mesi non sembra conferire ulteriori benefici per il popolazione complessiva. Il programma di sviluppo clinico continuerà a valutare il follow-up a lungo termine e la tempistica ottimale per una potenziale rivaccinazione.
Tony Wood, Chief Scientific Officer, GSK, ha dichiarato: “Il nostro obiettivo è fornire un elevato livello di protezione per gli anziani più a rischio di RSV. Questi dati mostrano l'efficacia di una singola dose del nostro vaccino in due stagioni RSV contro RSV-LRTD, anche nelle popolazioni più a rischio a causa dell'età o delle condizioni mediche sottostanti. Ciò rafforza la nostra fiducia nel suo potenziale per avere un impatto significativo sulla salute pubblica. Non vediamo l'ora di discutere questi risultati con le autorità di regolamentazione e gli organismi che raccomandano i vaccini e di raccogliere più dati dal programma di sviluppo clinico in corso".
I dati sulla sicurezza e sulla reattogenicità erano coerenti con le osservazioni iniziali del programma di fase III. Il vaccino è stato generalmente ben tollerato. Gli eventi avversi più frequentemente osservati sono stati dolore al sito di iniezione, affaticamento, mialgia, cefalea e artralgia. Questi erano generalmente da lievi a moderati e transitori.
GSK presenterà questi dati alla riunione del Comitato consultivo sulle pratiche di immunizzazione (ACIP) dei Centri statunitensi per il controllo e la prevenzione delle malattie (CDC) il 21 giugno 2023. Saranno inoltre analizzati i dati di due studi di co-somministrazione dell'influenza (quadrivalente ad alta dose e quadrivalente adiuvato). presentato, aggiungendo ai dati sulla co-somministrazione della vaccinazione contro l'influenza quadrivalente stagionale nell'attuale etichetta del prodotto statunitense. Questi dati saranno sottoposti alla Food and Drug Administration (FDA) statunitense e ad altri regolatori per la revisione.
A proposito di AReSVi-006
Questo è uno studio di fase III randomizzato, controllato con placebo, in cieco per l'osservatore, multinazionale per dimostrare l'efficacia di una singola dose del vaccino adiuvato per adulti anziani RSV di GSK nell'arco di tre anni e dopo un programma di rivaccinazione annuale negli adulti di età pari o superiore a 60 anni . Sono stati arruolati circa 25.000 partecipanti provenienti da 17 paesi. L'endpoint primario dello studio era l'efficacia del vaccino contro RSV-LRTD dopo una stagione di RSV. I primi risultati sono stati pubblicati nel New England Journal of Medicine nel febbraio 2023.
Dopo la prima stagione, 12.469 partecipanti al braccio del vaccino sono stati nuovamente randomizzati per ricevere il vaccino RSV o il placebo e sono stati seguiti per l'insorgenza di RSV-LRTD. L'efficacia del vaccino di una singola dose contro RSV-LRTD dopo due stagioni e l'efficacia del vaccino dopo la rivaccinazione annuale erano endpoint secondari di conferma.
Informazioni sul vaccino contro il virus respiratorio sinciziale, adiuvato
Il vaccino contro il virus respiratorio sinciziale, adiuvato, contiene glicoproteina F ricombinante stabilizzata nella conformazione di prefusione (RSVPreF3). Questo antigene è combinato con l'adiuvante AS01E proprietario di GSK.
Il vaccino è stato approvato dalla FDA statunitense il 3 maggio 2023 per la prevenzione della LRTD causata da RSV in individui di età pari o superiore a 60 anni.
Nel giugno 2023, la Commissione europea ha autorizzato il vaccino per l'immunizzazione attiva per la prevenzione della LRTD causata da RSV negli adulti di età pari o superiore a 60 anni. Sono in corso revisioni normative in Giappone e in altri paesi.
Il vaccino non è approvato in nessun'altra parte del mondo. Il nome commerciale proposto rimane soggetto all'approvazione normativa in altri mercati.
Il sistema adiuvante AS01 proprietario di GSK contiene l'adiuvante QS-21 STIMULON concesso in licenza da Antigenics Inc., una consociata interamente controllata da Agenus Inc.
Il vaccino è stato approvato dalla FDA statunitense il 3 maggio 2023 per la prevenzione della LRTD causata da RSV in individui di età pari o superiore a 60 anni.
Nel giugno 2023, la Commissione europea ha autorizzato il vaccino per l'immunizzazione attiva per la prevenzione della LRTD causata da RSV negli adulti di età pari o superiore a 60 anni. Sono in corso revisioni normative in Giappone e in altri paesi.
Il vaccino non è approvato in nessun'altra parte del mondo. Il nome commerciale proposto rimane soggetto all'approvazione normativa in altri mercati.
Il sistema adiuvante AS01 proprietario di GSK contiene l'adiuvante QS-21 STIMULON concesso in licenza da Antigenics Inc., una consociata interamente controllata da Agenus Inc.
